
25 de dez. de 2011
23 de dez. de 2011
Bio-pneus
Bio-pneus
Você gostaria de usar um pneu verde em seu carro?
Mas não se preocupe com a estética, uma vez que o verde refere-se a ambientalmente correto.
A Goodyear e a Michelin uniram-se com empresas do setor de biotecnologia para desenvolver novas matérias-primas para pneus - matérias-primas que sejam totalmente renováveis.

E a escolha está recaindo sobre o açúcar - logo, os pneus ambientalmente corretos serão não apenas verdes, mas também doces.
Os primeiros protótipos desses "bio-pneus" já estão prontos e em testes, embora as empresas afirmem que ainda levará de 3 a 5 anos para que eles cheguem ao mercado.
Bio-isopreno
A principal matéria-prima para os pneus é o petróleo, embora utilize-se também a borracha natural, que é renovável - gasta-se cerca de 30 litros de petróleo para fabricar um pneu de um carro médio.
A Genencor, empresa de biotecnologia parceira do projeto, desenvolveu micróbios que imitam o processo natural que a seringueira usa para produzir o látex.
Esses micróbios usam como matéria-prima o açúcar comum, produzindo um composto químico chamado isopreno, hoje um derivado do petróleo.
Trocando alimentos por pneus
A notícia não é boa para o mercado de etanol no Brasil.
As usinas geralmente optam por fabricar açúcar em vez de álcool por ser o açúcar uma commoditie internacional, cotada em dólar, enquanto o etanol tem um mercado predominantemente doméstico.
Uma maior demanda por açúcar deverá exercer uma pressão de alta no mercado internacional do produto, reforçando a necessidade do desenvolvimento do chamado biocombustível de segunda geração.
A iniciativa das empresas também deverá encontrar resistência por competir com os produtos alimentícios.
Enquanto, no Brasil, o etanol compete com o açúcar, nos Estados Unidos obiocombustível é feito sobretudo à base de milho.
13 de dez. de 2011
Pneus Velhos: Reuse!!!
Pneus velhos viram proteção anti-ruído para estradas
Painéis de pneus

Quem roda pelas estradas que passam próximo aos grandes centros urbanos observa enormes muros de concreto, ao lado da estrada ou entre as pistas.
Essas construções servem tanto para minimizar o ruído da estrada que chega às áreas residenciais, quanto para isolar as pistas.
Os engenheiros desenvolveram uma técnica que usa o material dos pneus, com um gasto mínimo de energia, para a confecção de painéis.
Estes painéis podem ser montados como se fossem segmentos de um muro pré-moldado.
Barreira acústica eficiente
Depois de resolver os problemas estruturais, a boa surpresa veio quando os pesquisadores verificaram que o material poroso dos pneus velhos produz uma barreira acústica mais eficiente.
Além de uma maior absorção dos ruídos, as barreiras feitas com pneus reciclados são mais leves, minimizando os custos de engenharia durante a construção.
Embora o objetivo primário seja a construção de proteções acústicas para rodovias, o material poderá ser usado em outras aplicações similares.
1 de dez. de 2011
Dicas para a 3ª Certificação
20 de nov. de 2011
UFF 2012
52 - Oxi-redução
53 - Reações Orgânicas (Hidrólise de Ésteres)
54 - Solução Tampão
55 - Funções Orgânicas (Aminas e suas propriedades)
56 - Oxidação de Alcenos (Ozonólise)
57 - Cálculos Estequiométricos
58 - Cálculos Estequiométricos (Soluções)
59 - Reações Orgânicas (Reagente de Grignard)
Temas como Estequimetria, Funções Orgânicas e hidrólise de ésteres são sempre esperados em provas de vestibulares. No entanto, a UFF se valeu de uma prova com um conteúdo "lado B", como cálculo de pH em solução tampão, adição de reagente de grignard e teoria sobre propriedades do agente oxidante permanganato. O que deu um maior grau de dificuldade a prova. Nesta semana postarei as questões resolvidas.
Abraço.
17 de nov. de 2011
16 de nov. de 2011
8 de nov. de 2011
4 OIQ
COLÉGIO PEDRO II
2011 – ANO INTERNACIONAL DA QUÍMICA
4ª OLIMPÍADA INTERNA DE QUÍMICA
ANEXO AO REGULAMENTO
Parágrafo 60 – A pontuação final do aluno será igual à nota da primeira etapa x 1 mais a nota da discursiva x 2, podendo alcançar no máximo 30 pontos.
Art. 4º - Os alunos aprovados na 1ª etapa ganharão 0,5 ponto de bônus na média de química da 2ª certificação. Os alunos aprovados na 2ª etapa (nota maior ou igual a 6,0) ganharão 0,5 ponto de bônus na média de química da 3ª certificação.
Art. 50 – A primeira etapa da Olimpíada será realizada na própria Unidade Escolar do aluno, no dia 29/06/2011 (quarta-feira), das 11h30min às 13. A prova discursiva será realizada em 16/11/2011 (quarta-feira) na própria Unidade Escolar do aluno das 11h30min às 13h00.
Art. 80 – O resultado da primeira etapa da OIQCPII será divulgado até o dia 06/07/2011. O resultado da segunda etapa será divulgado até o dia 21/11/2011. O resultado final da 4ª OIQCPII será divulgado no dia 23/11/2011 em todas as Unidades Escolares II e III.
Art. 90 – A Solenidade de Encerramento da 4ª OIQCPII será realizada no dia 01/12/2011 (quinta-feira) às 18h30min em local a ser divulgado.
Art. 110 – Os 20 primeiros colocados de cada série serão premiados da seguinte forma: medalhas de ouro (1º ao 5º lugar), medalhas de prata (6º ao 10º lugar), medalhas de bronze (11º ao 15º lugar), e menções honrosas (16º ao 20º lugar).
COMISSÃO ORGANIZADORA DA 4ª OIQCPII
Em 24 de outubro de 2011.
7 de nov. de 2011
UFF 2012
Dicas do Professor e amigo Raphael Neves.
Dicas para UFF – 1ª Fase por Raphael Neves
A prova da UFF se caracteriza por ser uma prova muito abrangente em relação aos conteúdos abordados. Para esse vestibular é importante ficar ligado aos conteúdos menos cobrados, em outros vestibulares, como:
- Separação de misturas
- Oxirredução
- Reações químicas
- Hibridização e geometria do carbono
- Trasformações químicas e físicas
Além desses assuntos é importante ficar ligado aos conteúdos mais comuns aos vestibulares, como:
- Estequiometria
- Soluções
- Termoquímica
- Pilha
- Reconhecimento de funções orgânicas
4 de nov. de 2011
3 de nov. de 2011
Lipídios: as biomoléculas hidrofóbicas
Mais um caso de termo químico que se incorpora ao senso comum: os lipídios, há tempos, extrapolaram os livros de química. Definem um conjunto de substâncias químicas que, ao contrário das outras classes de compostos orgânicos, não são caracterizadas por algum grupo funcional comum, e sim pela sua alta solubilidade em solventes orgânicos e baixa solubilidade em água. Juntamente com as proteínas, ácidos nucléicos e carbo-hidratos, os lipídios são componentes essenciais das estruturas biológicas, e fazem parte de um grupo conhecido como biomoléculas. Os lipídios se encontram distribuidos em todos os tecidos, principalmente nas membranas celulares e nas células de gordura.
Existem diversos tipos de moléculas diferentes que pertencem à classe dos lipídios. Embora não apresentem nenhuma característica estrutural comumm todas elas possuem muito mais ligações carbono-hidrogênio do que as outras biomoléculas, e a grande maioria possui poucos heteroátomos. Isto faz com que estas moléculas sejampobres em dipolos localizados (carbono e hidrogênio possuem eletronegatividade semelhante). Uma das leis clássicas da química diz que "o semelhante dissolve o semelhante": daí a razão para estas moléculas seremfracamente solúveis em água ou etanol (solventes polares) e altamente solúveis em solventes orgânicos (geralmente apolares).
Ao contrário das demais biomoléculas, os lipídios não são polímeros, isto é, não são repetições de uma unidade básica. Embora possam apresentar uma estrutura química relativamente simples, as funções dos lipídios são complexas e diversas, atuando em muitas etapas cruciais do metabolismo e na definição das estruturas celulares.
Os químicos podem separar os lipídios de uma amostra biológica através de uma técnica conhecida como extração; um solvente orgânico é adicionado a uma solução aquosa da amostra e, com um auxílio de um funil de separação, obtém-se a fase orgânica rica em lipídios. Com a evaporação do solvente orgânico obtém-se o lipídio. É desta maneira que, em escala industrial, se obtém o óleo vegetal.
Como veremos a seguir, alguns lipídios têm a habilidade de formar filmes sobre a superfície da água, ou mesmo de formar agregados organizados na solução; estes lipídios possuem uma região, na molécula, polar ou iônica, que é facilmente hidratada. Este comportamento é característico dos lipídios que compõe a membrana celular. Os lipossomos são "microenvelopes" capazes de envolverem moléculas orgânicas e entregarem-nas ao "endereço biológico" correto.
Classificação dos lipídios
________________________
Ácidos Graxos
 |
A hidrólise ácida dos triacilglicerídios leva aos correspondentes ácidos carboxílicos - conhecidos como ácidos graxos. Este é o grupo mais abundante de lipídios nos seres vivos, e são compostos derivados dos ácidos carboxílicos. Este grupo é geralmente chamado de lipídios saponificáveis, porque a reação destes com uma solução quente de hidróxido de sódio produz o correspondente sal sódico do ácido carboxílico, isto é, o sabão.
Os ácidos graxos possuem um pKa da ordem de 4,8. Isto significa que, em uma solução onde o pH é 4,8, metade da concentração o ácido está ionizada; a um pH maior (7, por exemplo) praticamente todo o ácido encontra-se ionizado, formando um sal com o seu contra-íon; num pH menor (3, e.g.) todo o ácido encontra-se protonado.
 |
A natureza do cátion (contra-íon) determina as propriedades do sal carboxílico formado. Em geral, sais com cátions divalentes (Ca2+ ou Mg2+) não são bem solúveis em água, ao contrário do formado com metais alcalinos (Na+, K+, etc.), que são bastante solúveis em água e em óleo - são conhecidos como sabão. É por este motivo que, em regiões onde a água é rica em metais alcalinos terrosos, é necessário se utilizar formulações especiais de sabão na hora de lavar a roupa. Na água, em altas concentrações destes sais, ocorre a formação de micelas - glóbulos microscópicos formados pela agregação destas moléculas. Nas micelas, as regiões polares das moléculas de sabão encontram-se em contato com as moléculas de água, enquanto que as regiões hidrofóbicas ficam no interior do glóbulo, em uma pseudofase orgânica, sem contato com a água.
A adição de HCl a uma solução aquosa de sabão provoca a precipitação do ácido graxo, que é pouco solúvel em água e, em solução aquosa, tende a formar dímeros através de fortes ligações hidrogênio.
Composição de alguns óleos e gorduras |
 |
 |
Os ácidos graxos também podem ser classificados comosaturados ou insaturados, dependendo da ausência ou presença de ligações duplas carbono-carbono. Os insaturados (que contém tais ligações) são facilmente convertidos em saturados através da hidrogenação catalítica (este processo é chamado de redução). A presença de insaturação nas cadeias de ácido carboxílico dificulta a interação intermolecular, fazendo com que, em geral, estes se apresentem, à temperatura ambiente, no estado líquido; já os saturados, com uma maior facilidade de empacotamente intermolecular, são sólidos. A margarina, por exemplo, é obtida através da hidrogenação de um líquido - o óleo de soja ou de milho, que é rico em ácidos graxos insaturados.
________________________
Triacilglicerídios
 Conhecidos como gorduras neutras, esta grande classe de lipídios não contém grupos carregados. São ésteres do glicerol - 1,2,3-propanotriol. Estes ésteres possuem longas cadeias carbônicas atachadas ao glicerol, e a hidrólise ácida promove a formação dos ácidos graxos correspondentes e o álcool (glicerol).
Conhecidos como gorduras neutras, esta grande classe de lipídios não contém grupos carregados. São ésteres do glicerol - 1,2,3-propanotriol. Estes ésteres possuem longas cadeias carbônicas atachadas ao glicerol, e a hidrólise ácida promove a formação dos ácidos graxos correspondentes e o álcool (glicerol).
Nos animais, os TAGs são lipídios que servem, principalmente, para a estocagem de energia; as células lipidinosas são ricas em TAGs. É uma das mais eficientes formas de estocagem de energia, principalmente com TAGs saturados; cada ligação C-H é um sítio potencial para a reação de oxidação, um processo que libera muita energia.
 Os TAGs provindo de animais terrestres contém uma maior quantidade de cadeias saturadas se comparados aos TAGs de animais aquáticos. Embora menos eficientes no armazenamento de energia, as TAGs insaturadas oferecem uma vantagem para os animais aquáticos, principalmente para os que vivem em água fria: elas têm uma menor temperatura de fusão, permanecendo no estado líquido mesmo em baixas temperaturas. Se fossem saturadas, ficariam no estado sólido e teriam maior dificuldade de mobilidade no organismo do animal.
Os TAGs provindo de animais terrestres contém uma maior quantidade de cadeias saturadas se comparados aos TAGs de animais aquáticos. Embora menos eficientes no armazenamento de energia, as TAGs insaturadas oferecem uma vantagem para os animais aquáticos, principalmente para os que vivem em água fria: elas têm uma menor temperatura de fusão, permanecendo no estado líquido mesmo em baixas temperaturas. Se fossem saturadas, ficariam no estado sólido e teriam maior dificuldade de mobilidade no organismo do animal.
Os TAGs podem ser chamados de gorduras ou óleos, dependendo do estado físico na temperatura ambiente: se forem sólidos, são gorduras, e líquidos são óleos. No organismo, tanto os óleos como as gorduras podem ser hidrolisados pelo auxílio de enzimas específicas, as lipases (tal como a fosfolipase A ou a lipase pancreática), que permitem a digestão destas substâncias.
________________________
Autor: qmwweb
Texto completo: http://www.qmc.ufsc.br/qmcweb/artigos/lipidios/lipidios.html
25 de out. de 2011
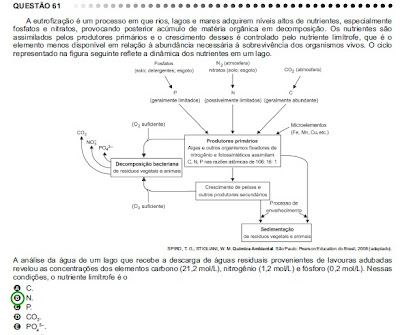
ENEM - Química, é claro!
 Essa questão trata de deslocamento do equilíbrio químico.
Essa questão trata de deslocamento do equilíbrio químico.ENEM - Química, é claro!
ENEM - Química, é claro!
 Essa questão aborda a síntese de amidas.
Essa questão aborda a síntese de amidas.ENEM - Química, é claro!
ENEM - Química, é claro!
 A questão afirma que o processo de industrialização da mamona origina o óleo (apolar) e uma massa orgânica, a torta de mamona, que é muito proteica, mas apresenta compostos tóxicos e alergênicos.
A questão afirma que o processo de industrialização da mamona origina o óleo (apolar) e uma massa orgânica, a torta de mamona, que é muito proteica, mas apresenta compostos tóxicos e alergênicos.ENEM - Química, é claro!
 O tratamento da água de rios com a finalidade de torná-la própria para o consumo humano consiste numa série de etapas envolvendo separações de misturas por métodos físicos e físico-químicos, além da adição de algumas substâncias químicas a fim adequá-la a nossa necessidade.
O tratamento da água de rios com a finalidade de torná-la própria para o consumo humano consiste numa série de etapas envolvendo separações de misturas por métodos físicos e físico-químicos, além da adição de algumas substâncias químicas a fim adequá-la a nossa necessidade.ENEM - Química, é claro!
ENEM - Química, é claro!

21 de out. de 2011
APOIO!!
16 de out. de 2011
Gabaritos
4. [C] 5. [B]
6. a)
7. [A] 8. [A] 9. [C]
3 série - Lista de Orgânica
1. [B]
3. Observe a figura adiante:
b) Ácido propanóico.2. a)HCOOCH2CH3+H2O = HCOOH+CH3CH2OH

4. [C]
Observe a fórmula estrutural plana a seguir

b) Nomenclatura de W: propanona
Percentagem de carbono = 25% de átomos C.
7. a) Isomeria de posição, pois A é um álcool secundário (2-butanol) e B é um álcool primário (1-butanol).
b) 1-buteno ou 2-buteno ou éter di-secbutílico

30 de set. de 2011
Baterias de lítio ganham o poder do silício
Oito vezes melhor
Cientistas sintetizaram um novopolímero que consegue absorver até oito vezes mais lítio do que o material usado nas baterias recarregáveis atuais.
Para afirmar que o novo material pode criar uma nova geração de baterias para viabilizar definitivamente os carros elétricos, os cientistas não se restringiram a fazer projeções matemáticas.
Eles testaram o novo material por mais de um ano, demonstrando que ele suporta centenas de ciclos de carga e descarga sem perder suas características.
Silício e íons de lítio
"Anodos de alta capacidade parabaterias de íons de lítio sempre se defrontaram com o desafio da alteração de volume quando os eletrodos absorvem o lítio," comentou Gao Liu, dos Laboratórios Berkeley, nos Estados Unidos.
Quase todos os anodos das baterias de lítio hoje são feitos de grafite, que é eletricamente condutor mas tem uma capacidade de expansão apenas modesta - os íons de lítio são armazenados entre as camadas degrafeno que formam o grafite.
O silício é o material com maior capacidade de absorção de íons de lítio entre todos os materiais que se conhece. Mas ele triplica de volume quando está totalmente carregado, o que gera trincas no material durante os ciclos de carga e descarga, diminuindo radicalmente a vida útil das baterias.
Uma abordagem vinha sendo a mistura de polímeros ao silício para que o material ganhasse em flexibilidade. Mas isso torna necessário a adição de carbono para a condução elétrica, e o carbono acaba sendo expulso da mistura nos repetidos ciclos de incha e desincha do anodo.
Polímero condutor
A solução veio na forma de um polímero - uma espécie de plástico - que conduz eletricidade e se liga fortemente às partículas de silício que retêm o lítio no anodo da bateria.
No processo de absorção do lítio - durante o carregamento da bateria - o polímero incha, expandindo-se a até três vezes seu volume inicial. Durante o descarregamento, ele libera o lítio e encolhe novamente para seu tamanho normal.
O polímero condutor de eletricidade resolveu o problema ao dispensar a adição do carbono.
Segundo os pesquisadores, o novo anodo usa apenas materiais já disponíveis, de baixo custo e compatíveis com as tecnologias da fabricação das baterias recarregáveis de lítio.
20 de set. de 2011
Fusão nuclear a laser: solução para energia limpa?

Energia das estrelas
O sonho de dominar a fusão nuclear- a energia das estrelas - continua de fato brilhando, agora ainda mais.
A fusão a laser é uma tecnologia diferente da chamada "fusão magneticamente induzida", usada noITER e em outros experimentos.
Esta tecnologia está sendo usada no projeto Hiper, que pretende iniciar a fusão nuclear usando um equipamento de raio laser do tamanho de um estádio de futebol, e no projeto JET (Joint European Torus).
Agora, pelo menos três parceiros de peso acabam de anunciar um esforço conjunto para tentar domar a fusão nuclear a laser.
A equipe será formada pelo Laboratório Nacional Lawrence Livermore (EUA), Laboratório Rutherford Appleton (Grã-Bretanha) e pela empresa privada AWE.
O que é a fusão a laser?
Em altas temperaturas e pressões, os núcleos dos isótopos pesados de hidrogênio - deutério e trítio (ou trício) - formam um plasma, podendo ser fundidos para formar hélio, liberando energia e um nêutron.
Disparando uma saraivada sincronizada de laser pulsado é possível vaporizar a superfície de uma esfera cheia desses isótopos, forçando a esfera a implodir, produzindo assim as condições de fusão em seu interior durante alguns bilionésimos de segundo.
A física se assemelha à detonação de uma bomba termonuclear (ou bomba de hidrogênio) - embora em uma escala muito menor.
Para saber mais: Fusão nuclear a laser6 de set. de 2011
Menor motor elétrico do mundo tem apenas uma molécula
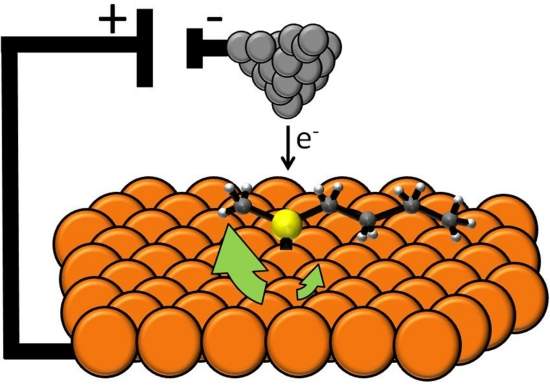
Motor molecular elétrico
Químicos da Universidade de Tufts, nos Estados Unidos, criaram o menor motor molecular acionado por eletricidade.
O motor elétrico molecular mede apenas 1 nanômetro.
Ele consiste em uma única molécula de sulfeto de butil metil posta sobre uma superfície de cobre.
Esta molécula, que contém enxofre, possui átomos de carbono e hidrogênio formando uma estrutura que lembra dois braços, com quatro carbonos de um lado e um do outro.
Estas cadeias de carbono ficam livres para girar em torno da ligação de enxofre e cobre, que funciona como eixo.
Motor frio
O fornecimento da eletricidade e o controle do motor molecular foi feito com um microscópio de varredura por tunelamento (STM-LT), que coloca as amostras sendo observadas em temperaturas criogênicas e que usa um feixe de elétrons, em vez de luz, para "enxergar" moléculas.
A finíssima ponta de metal do microscópio fornece uma carga elétrica para a molécula de sulfeto de butil metil, que havia sido previamente colocada sobre uma superfície de cobre.
Para ver seu funcionamento, contudo, é necessário manter uma temperatura de 5 Kelvin (-268º C).
Em temperaturas mais altas do que isso, o motor gira rápido demais, o que torna difícil controlar sua rotação e mesmo medir quantas voltas ele dá.
Livros dos recordes
O desenvolvimento faz parte de uma nova classe de dispositivos que poderão ser usados em aplicações que vão da medicina à engenharia.
Segundo Charles Sykes, coordenador da equipe, eles vão submeter o motor elétrico molecular para o Guinness World Records.
"Tem havido progressos significativos na construção de motores moleculares alimentados por luz e por reações químicas, mas esta é a primeira vez que se constrói um motor elétrico molecular," disse Sykes.
Na verdade não é. Embora o novo motor seja o menor, cientistas holandeses construíram o primeiro motor molecular totalmente elétrico em 2010.
Fonte: http://www.inovacaotecnologica.com.br/noticias/noticia.php?artigo=menor-motor-molecular-eletrico-uma-molecula&id=010170110905&ebol=sim31 de ago. de 2011
Revestimento controla o calor dentro de uma sala
24 de ago. de 2011
Aula sobre Pilhas (Fisqui)
Aula sobre reações de combustão. (Orgânica!!!)
18 de ago. de 2011
Aula de Oxidação de Alcoóis (Orgânica!!!!rs)
Aula Solução Tampão (é fisqui, meninas rsrsrsrs)
16 de fev. de 2011
Um pouco mais sobre a Radioatividade
Química nuclear na medicina
 A medicina nuclear envolve dois usos distintos de radioisótopos: terapia e diagnóstico. No uso terapêutico, a radiação é empregada na tentativa de curar doenças. Algumas formas de câncer, por exemplo, podem ser tratadas por radioterapia. As células do tumor cancerígeno são destruídas pelos efeitos da radiação. Embora o feixe radioativo seja apontado precisamente sobre o tumor, diversos efeitos colaterais acompanham o tratamento. As células da mucosa intestinal, por exemplo, são particularmente susceptíveis à radiação, fazendo com que os pacientes sofram de náuseas e vômitos.
A medicina nuclear envolve dois usos distintos de radioisótopos: terapia e diagnóstico. No uso terapêutico, a radiação é empregada na tentativa de curar doenças. Algumas formas de câncer, por exemplo, podem ser tratadas por radioterapia. As células do tumor cancerígeno são destruídas pelos efeitos da radiação. Embora o feixe radioativo seja apontado precisamente sobre o tumor, diversos efeitos colaterais acompanham o tratamento. As células da mucosa intestinal, por exemplo, são particularmente susceptíveis à radiação, fazendo com que os pacientes sofram de náuseas e vômitos.
 Fotoscan com I-131 da glândula tireóide de um paciente obeso |
Os radioisótopos também podem ser empregados com o propósito de diagnóstico, fornecendo informações sobre o tipo ou extensão da doença. O isótopo iodo-131 é usado para determinar o tamanho, forma e atividade da glândula tireóide. O paciente bebe uma solução de KI, incorporando iodo-131. O corpo concentra o iodo na tireóide. Após algum tempo, um detector de radiação varre a região da glândula e a informação é exibida, no computador, sob a forma visual. A figura é então chamada de fotoscan. O aparelho lê apenas a radiação gama, mas o I-131 também emite radiação beta. O tempo de meia-vida do I-131 é de apenas 8 minutos, o que faz com que toda a radioatividade cesse após algumas horas.
O radiosótopo ideal para uso de diagnóstico deveria possuir algumas qualidades: emitir partículas gama, pois estas tem um grande poder de penetração, e podem sair do organismo; não emitir, preferencialmente, partículas alfa ou beta; o tempo de meia-vida deve ser ideal: nem tão curto, que não possa ser detectado a tempo, nem tão longo, onde atividade ainda existiria após o diagnóstico. Felizmente, a natureza nos presenteou com um isótopo que atende a quase todas as necessidades: o tecnécio-99m, 99mTc. A letra m corresponde a metaestável: o isótopo pode perder alguma energia e se tornar estável. É isto o que ocorre: o átomo 99mTc emite uma partícula gama e se torna o átomo 99Tc, estável:
A energia da radiação emitida pelo 99mTc é idealmente correta, e o t1/2 é de 6 horas. O isótopo é largamente empregado na varredura dos rins, fígado, bexiga, cérebro e pulmões. Este isótopo tem substituído um grande número de outros radioisótopos menos ideais, e a demanda para a produção do 99mTc é muito grande, o que tornou o seu preço bastante alto.
99mTc ![]() 99Tc + gama
99Tc + gama
Fonte:qmcweb
leia o artigo completo em: http://www.qmc.ufsc.br/qmcweb/artigos/nuclear/medicina.html

